Η παραβίαση της απαγορευτικής αρχής του Pauli …
… και η απέχθεια του Pauli για τους χημικούς
Η απαγορευτική αρχή του Pauli αποτελεί μια από τις πιο θεμελιώδεις αρχές της φυσικής. Η αρχή αυτή αποτελεί την βάση της ερμηνείας του περιοδικού πίνακα των χημικών στοιχείων, της αγωγιμότητας των μετάλλων, του σιδηρομαγνητισμού, της πίεσης εκφυλισμού που κρατά τους λευκούς νάνους και τους αστέρες νετρονίων σταθερούς, καθώς επίσης και άλλα φαινόμενα στη φυσική, την χημεία και την βιολογία.
Η ισχύς της απαγορευτικής αρχής του Pauli για τα ηλεκτρόνια θα ερευνηθεί στα πειράματα VIP (VIolation of Pauli exclusion principle) και VIP-2 στο εργαστήριο του Gran Sasso. Τα πειράματα αυτά θα ψάξουν για ακτίνες Χ από ατομικές μεταβάσεις σε άτομα χαλκού, οι οποίες δεν επιτρέπονται σύμφωνα με την απαγορευτική αρχή του Pauli. Τα υποψήφια γεγονότα, αν υπάρχουν, προέρχονται από την μετάβαση ενός ηλεκτρονίου από το τροχιακό 2p στην θεμελιώδη κατάσταση, η οποία καταλαμβάνεται ήδη από δυο ηλεκτρόνια.
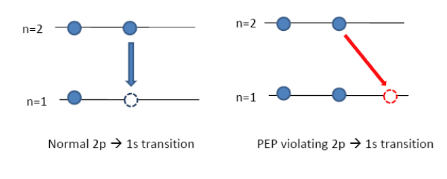
Όταν ένα ηλεκτρόνιο στο άτομο του χαλκού επιστρέφει στην κενή θέση της θεμελιώδους κατάστασης, εκπέμπεται φωτόνιο ακτινοβολίας Χ ενέργειας 8,040 keV. To πείραμα VIP ψάχνει για την απαγορευμένη μετάβαση η οποία, αν συμβαίνει, προκαλεί την εκπομπή φωτονίου με ενέργεια μετατοπισμένη κατά 300 eV, από τα 8.040 στα 7.729 keV.
Προς το παρόν, το όριο στην πιθανότητα παραβίασης της απαγορευτικής αρχής του Pauli από ηλεκτρόνια που θέτει το πείραμα VIP είναι 4,7×10−29. Το επερχόμενο πείραμα VIP-2 θα βελτιώσει το όριο του VIP κατά δυο τάξεις μεγέθους [Test of the Pauli Exclusion Principle in the VIP-2 underground experiment].
Ας σημειωθεί ότι δεν υπάρχει κάποιο μοντέλο στην κβαντική θεωρία πεδίου που να περιλαμβάνει μικρές παραβιάσεις της απαγορευτικής αρχής. Tα ηλεκτρόνια του χαλκού που θα παραβίαζαν την αρχή του Pauli, δεν θα μπορούσαν να ιδωθούν ούτε ως φερμιόνια ούτε ως μποζόνια. Γι αυτό οι ερευνητές του πειράματος VIP αναφέρονται στην περίπτωση του κβαντικού φαινομένου Hall [μια παιδαγωγική ανασκόπηση εδώ: https://arxiv.org/abs/0711.4697], το οποίο αποτελεί ένα παράδειγμα συστήματος συμπυκνωμένης ύλης δυο διαστάσεων, στο οποίο ο διαχωρισμός φερμιονίων και μποζονίων δεν δουλεύει. Εμπνεόμενοι από αυτή την φυσική αυτών των ειδικών συστημάτων οι ερευνητές του VIP, αναζητούν την παραβίαση της απαγορευτικής αρχής σε άλλα συστήματα.
Όμως, επειδή μάλλον θα αργήσουν πολύ για να ανακαλύψουν κάποια παραβίαση της αρχής του Pauli, εμείς ας υπενθυμίσουμε λίγα πράγματα για την αρχή που αποτελεί την βάση της ερμηνείας του περιοδικού πίνακα των χημικών στοιχείων.
Η απαγορευτική αρχή του Pauli
Στην κβαντομηχανική εισάγονται τρεις κβαντικοί αριθμοί για τον καθορισμό της κατανομής των ηλεκτρονικού νέφους ή ατομικού τροχιακού. Οι κβαντικοί αυτοί αριθμοί προκύπτουν από την επίλυση της εξίσωσης Schrödinger για το άτομο του υδρογόνου και είναι ο κύριος κβαντικός αριθμός (n=1,2, 3,..) – καθορίζει το μέγεθος του τροχιακού, ο δευτερεύων κβαντικός αριθμός ή αζιμουθιακός (ℓ=0,1,2, … , n-1) – καθορίζει το σχήμα του τροχιακού και ο μαγνητικός κβαντικός αριθμός (mℓ=- ℓ, -ℓ+1, …-1,, 0, +1, … ℓ-1, ℓ) – καθορίζει τον προσανατολισμό του ηλεκτρονιακού νέφους σε σχέση με τους άξονες x, y, z. Κάθε δυνατή τριάδα κβαντικών αριθμών (n, ℓ, mℓ) οδηγεί σε μια λύση της εξίσωσης Schrödinger, καθορίζοντας ένα συγκεκριμένο τροχιακό του ατόμου.
Ο Pauli ήταν ο πρώτος που διαπίστωσε πως οποιοδήποτε ηλεκτρόνιο σε οποιοδήποτε άτομο έπρεπε να χαρακτηρίζεται και από έναν τέταρτο κβαντικό αριθμό με δυο δυνατές τιμές. Aυτός είναι ο κβαντικός αριθμός του spin (ms=±1/2), ο οποίος όμως δε συμμετέχει στη διαμόρφωση της τιμής της ενέργειας του ηλεκτρονίου και κατά συνέπεια στο καθορισμό του ατομικού τροχιακού.
Και για να εξηγηθεί ο περιοδικός πίνακας των χημικών στοιχείων, πρέπει να αποδεχτούμε πως είναι αδύνατον να υπάρχουν στο ίδιο άτομο δυο ηλεκτρόνια με την ίδια τετράδα κβαντικών αριθμών (n, l, ml, ms). Πρόκειται για την περίφημη απαγορευτική αρχή του Pauli, μια ονομασία που δόθηκε από τον Paul Dirac.
Έτσι, δυο ηλεκτρόνια με τους ίδιους κβαντικούς αριθμούς δεν μπορούν να καταλαμβάνουν το ίδιο τροχιακό. Για τον λόγο αυτό ο κανόνας 2n2 του Bohr έδινε σωστά αποτελέσματα – δυο ηλεκτρόνια στον εσώτερο φλοιό, οκτώ στον επόμενο, δεκαοκτώ στον αμέσως επόμενο κ.ο.κ. Αυτός επίσης είναι ο λόγος για τον οποίο τα ηλεκτρόνια σε ένα άτομο δεν πέφτουν στην θεμελιώδη κατάστασή του.
Γιατί ο Pauli μισούσε τους χημικούςΗ πεμπτουσία των χημικών, ο περιοδικός πίνακας των στοιχείων, βασίζεται στην απαγορευτική αρχή του Pauli. Όμως παρά την τεράστια συνεισφορά του Pauli στην Χημεία, κατά βάθος μισούσε τους χημικούς για δυο λόγους κυρίως:
Κατ’ αρχήν, ο πατέρας του, που ήταν χημικός διεθνούς φήμης στο πανεπιστήμιο της Βιένης, εγκατέλειψε την μητέρα του για μια γυναίκα συνομήλικη του γιού του – τότε ο Pauli ήταν 27 ετών – και το γεγονός αυτό οδήγησε την μητέρα του σε αυτοκτονία.
Από την άλλη, προς το τέλος της δεκαετίας του 1920, ο Pauli ερωτεύτηκε και παντρεύτηκε μια εντυπωσιακή γυναίκα από τον χώρο του θεάματος. Είχε διατυπώσει την απαγορευτική αρχή του και ήταν ήδη μεγάλο όνομα στον χώρο της φυσικής, γεγονός που χρησιμοποίησε απροκάλυπτα για να σαγηνέψει την γυναίκα του, η οποία όμως τον εγκατέλειψε πριν καν συμπληρώσουν έναν χρόνο γάμου. Κι όπως ανέφερε ο ίδιος, αυτό που τον είχε πικράνει περισσότερο ήταν ότι τον παράτησε για έναν χημικό! «Μακάρι να ήταν ταυρομάχος – κάποιος με τον οποίο δεν θα μπορούσα να αναμετρηθώ. Αλλά για έναν χημικό;»
Επομένως, αν ζούσε σήμερα ο Pauli, σίγουρα θα γινόταν έξαλλος αν μάθαινε πως μεταξύ των ερευνητών που προσπαθούν να αποδείξουν την παραβίαση της απαγορευτικής αρχής του βρίσκονται και χημικοί, με εξειδίκευση στην ατομική φασματοσκοπία.
Η απαγορευτική αρχή του Pauli βασίζεται στην θεμελιώδη διαφορά μεταξύ κλασικής και κβαντική φυσικής ως προς τη δυνατότητα διάκρισης των ταυτόσημων σωματιδίων ενός συστήματος. Όταν λέμε ταυτόσημα σωματίδια εννοούμε τα σωματίδια που έχουν τις ίδιες ακριβώς φυσικές ιδιότητες όπως μάζα, φορτίο, σπιν και όλους τους κβαντικούς αριθμούς που απαιτούνται για τον πλήρη καθορισμό της ταυτότητάς τους.
Φερμιόνια και Μποζόνια
Στην κλασική φυσική τα ταυτόσημα σωματίδια μπορούν πάντα να διακριθούν μεταξύ τους, δεδομένου ότι το κάθε σωματίδιο διαθέτει την δική του τροχιά. Έτσι σε κάθε χρονική στιγμή, σύμφωνα πάντα με την κλασσική φυσική, μπορούμε να γνωρίζουμε κάθε χρονική στιγμή που βρίσκεται το κάθε σωματίδιο και έτσι να τα διακρίνουμε μεταξύ τους. Αντίθετα, στην κβαντική φυσική σωματίδια που ανήκουν στο ίδιο φυσικό σύστημα είναι αδύνατον να διακριθούν το ένα από το άλλο εφόσον περιγράφονται από επικαλυπτόμενες κυματοσυναρτήσεις που επιτρέπουν τα σωματίδια του συστήματος να βρίσκονται στο ίσιο σημείο του χώρου, γεγονός που καθιστά την διαφοροποίησή τους αδύνατη.
Αυτή η θεμελιώδης διαφορά απεικονίζεται καθαρά στο επόμενο σχήμα:
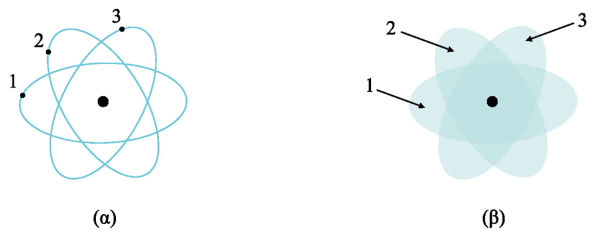
Η διαφορά μεταξύ κλασικής και κβαντικής φυσικής ως προς τη διακρισιμότητα των ταυτόσημων σωματιδίων. Τα ηλεκτρόνια ενός «κλασικού ατόμου» (Σχ. α) μπορούν πάντα να διακριθούν χάρις στη μοναδικότητα της τροχιάς τους ενώ το αντίστοιχο «κβαντικό άτομο» (Σχ. β) η διάκρισή τους είναι αδύνατη, αφού τα σωματίδια περιγράφονται από επικαλυπτόμενες κυματοσυναρτήσεις και συνπώς μπορούν να βρεθούν στο ίδιο σημείο του χώρου.
Στην κβαντική μηχανική λοιπόν τα ταυτόσημα σωματίδια που ανήκουν στο ίδιο φυσικό σύστημα είναι αδύνατον να διακριθούν μεταξύ τους και αυτό αποτελεί ένα θεμελιώδες φυσικό γεγονός που είναι γνωστό ως αρχή της μη διακρισιμότητας των ταυτόσημων σωματιδίων.
Μια αυτονόητη συνέπεια αυτής της αρχής είναι ότι τα ταυτόσημα σωματίδια που ανήκουν στο ίδιο φυσικό σύστημα – και επομένως έχουν επικαλυπτόμενα νέφη πιθανότητας – θα πρέπει να περιγραφούν κατά τέτοιο τρόπο ώστε η διάκρισή τους – ποιο είναι το 1, ποιο το 2 κ.λπ. – να είναι θεμελιωδώς αδύνατη. Όσο αθώα κι αν ακούγεται αυτή η απαίτηση έχει δραστικές συνέπειες στην κβαντομηχανική περιγραφή ενός συστήματος ταυτόσημων σωματιδίων.
Πολύ εύκολα μπορεί να δειχθεί πως η αρχή της μη διακρισιμότητας των ταυτόσημων σωματιδίων μας οδηγεί στο εξής συμπερασμα: Η κυματοσυνάρτηση ενός συστήματος δυο ταυτόσημων σωματιδίων πρέπει να είναι συμμετρική ή αντισυμμετρική ως προς την εναλλαγή των μεταβλητών της: Ψ(1,2)= ±Ψ(2,1)
Πιο από τα δυο πρόσημα πρέπει να επιλεγεί; Η απάντηση περιέχεται στην (γενικευμένη) αρχή του Pauli: Όλα τα σωματίδια με ακέραιο σπιν (s=0, 1, 2,…) – περιγράφονται από συμμετρικές κυματοσυναρτήσεις, ενώ όλα τα σωματίδια με ημιακέραιο σπιν (s=1/2, 3/2,…) – τα αποκαλούμενα φερμιόνια – από κυματοσυναρτήσεις που είναι αντισυμμετρικές ως προς την εναλλαγή των μεταβλητών τους.
Εξαιτίας της αρχής αυτής δυο ηλεκτρόνια με παράλληλα (ίδιο) σπιν κρατούνται μακριά το ένα από το άλλο, αφού η χωρική κυματοσυνάρτηση αντισυμμετρική, οπότε ψ(r1,r2)=-ψ(r2,r1) και για r1=r2=r προκύτπει ψ(r,r)=-ψ(r,r), οπότε ψ(r,r)=0, που σημαίνει ότι η πυκνότητα πιθανότητας να βρούμε δυο ηλεκτρόνια στο ίδιο σημείο του χώρου είναι ακριβώς μηδέν! Και δεν χρειάζεται καμία ιδιαίτερη φαντασία για να αντιληφθεί κανείς ότι αυτή είναι μια ειδική εκδήλωση της απαγορευτικής αρχής του Pauli. Αφού τα σωματίδια έχουν το ίδιο σπιν, προφανώς δεν μπορούν να βρεθούν και στο ίδιο σημαίο του χώρου, διότι τότε θα είχαν τους ίδιους «κβαντικούς αριθμούς», δηλαδή τα ίδια ακριβώς χαρακτηριστικά: μετά από μια μέτρηση που θα τα εντόπιζε στο ίδιο ακριβώς σημείο και με το ίδιο σπιν, τα δυο σωματίδια θα περιγράφονταν από την ίδια κβαντική κατάσταση. Δηλαδή αυτό που αποκλείει η απαγορευτική αρχή. Δυο ηλεκτρόνια που έχουν παράλληλα σπιν κρατιούνται μακριά το ένα από το άλλο! Ενώ δεν υπάρχει καμιά τέτοια … διάθεση αποφυγής όταν τα σωματίδια έχουν αντιπαράλληλα σπιν, ιότι τα΄τοε η χωρική κυματοσυνάρτηση είναι συμμετρική και δεν μηδενίζεται για r1=r2=r αφού ψ(r1,r2)=ψ(r2,r1). Τα παράλληλα σπιν αλληλοαποφεύγονται, ενώ τα αντιπαράλληλα «θέλουν» να βρίσκονται κοντά!
Φερμιόνια είναι τα ηλεκτρόνια,τα πρωτόνια, τα νετρόνια και γενικότερα όλα τα σωματίδια που αποτελούν τους βασικούς δομικούς λίθους της ύλης. Και ως φερμιόνια υπακούουν στην απαγορευτική αρχή του Pauli – αλλιώς δεν θα υπήρχαν ούτε πολυηλεκτρονικά άτομα ούτε οι πυρήνες τους. Αντίθετα, όλα τα σωματίδια φορείς των αλληλεπιδράσεων, όπως τα φωτόνια, είναι μποζόνια. Και πρέπει να είναι μποζόνια ώστε να μην υπακούουν στην αρχή Pauli για να είναι δυνατή η συνύπαρξή τους στην ίδια κβαντική κατάσταση, που είναι απαραίτητη προϋπόθεση για την δημιουργία ενός μακροσκοπικού κυματικού φαινομένου.
περισσότερες λεπτομέρειες για την απαγορευτική αρχή του Pauli, σε λυκειακό επίπεδο ΕΔΏ: ebooks.edu.gr και σε λίγο πιο προχωρημένο επίπεδο ΕΔΩ: Τραχανάς Στέφανος, ΚΒΑΝΤΟΜΗΧΑΝΙΚΗ ΙΙ

Δεν υπάρχουν σχόλια:
Δημοσίευση σχολίου